Gefrierprozesse
Meereis ist nicht einfach „nur“ gefrorenes Wasser. Denn die im Meerwasser enthaltenen Salze verändern seine Eigenschaften – und dabei besonders sein Gefrierverhalten – ganz erheblich.
In diesem Wissensteil werden zunächst die grundlegenden physikalischen Eigenschaften von Wasser betrachtet, welche die Basis für das Verständnis der Meereisbildung legen. Im nächsten Schritt wird der Salzgehalt von Meerwasser beleuchtet. Was ist Salz überhaupt? Welche Salze sind in Ozeanwasser gelöst? Und wie salzig ist das Wasser in verschiedenen Ozeanregionen?
Wichtig zu wissen ist auch, welchen Einfluss der Salzgehalt auf den Gefrierpunkt von Meerwasser hat, warum es ab einer bestimmten Salinität die Besonderheit der Dichteanomalie verliert und wie sich das auf den Gefrierprozess im Ozean auswirkt.
Wenn Meerwasser gefriert, verdrängen die Wassermoleküle den Salzanteil aus der entstehenden Kristallstruktur in das umliegende Wasser. Nach und nach entsteht so im Eis ein komplexes Kanalsystem aus Hohlräumen, in dem sich sehr salzige, aufkonzentrierte Sole sammelt. Sinkt die Temperatur im Meereis, gefriert ein Teil des Meerwassers in den Soleporen, die dadurch kleiner werden, und der Salzgehalt in der noch flüssigen Sole steigt. Diese Abhängigkeit der Meereiszusammensetzung von der Temperatur lässt sich gut mit einem Phasendiagramm beschreiben.
Die danach dargestellte besondere Kristallstruktur des Eises ist unter anderem dafür verantwortlich, dass es sich bei Druck aus einer bestimmten Richtung plastisch verformen lässt, bei Druck aus anderen Richtungen aber starr verhält. Darüber hinaus hat die Kristallstruktur Einfluss darauf, wie Meereis wächst.
Im abschließenden Teil wird erläutert, wie die im Ozean entstehenden Eiskristalle an die Wasseroberfläche aufsteigen und dort das sogenannte frazil-ice bilden. Es wird dargestellt (Wachstum von Meereis), wie sich daraus je nach Wetterlage feste Eisschichten (Nilas) oder kleine Schollen (Pfannkuchen-Eis) entwickeln, die – wenn sie durch Driftprozesse übereinander geschoben werden – bis zu 50 Meter hohe Presseisrücken bilden können.
Gefrierprozesse von Meereis
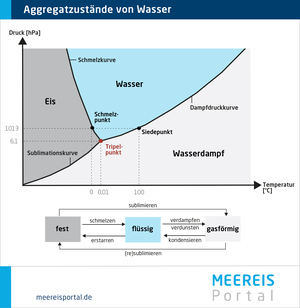
Wasser (H2O) ist der einzige Stoff der Erde, der unter den hier vorherrschenden Klimaverhältnissen in den drei klassischen Aggregatszuständen fest, flüssig und gasförmig vorkommt. Wechselt das Wasser seinen Aggregatszustand (Phasenübergang), wird Energie umgesetzt. Je nach Phasenübergang wird entweder Energie aufgenommen und gebunden (Schmelzen, Verdampfen) oder freigegeben (Kondensieren, Gefrieren). Aggregatzustände und Phasenübergänge von Wasser kann man in einem Druck-Temperatur-Diagramm darstellen. Aus diesem Diagramm (siehe Abbildung) kann man unter anderem ablesen, dass bei Normaldruck (1013 hPa) der Gefrierpunkt (= Schmelzpunkt) von Wasser bei 0 °C und der Siedepunkt bei 100 °C liegt. Bei höherem Druck liegt der Schmelzpunkt niedriger und der Siedepunkt höher. Bei niedrigerem Druck steigt der Schmelzpunkt an und die Siedepunkttemperatur nimmt ab. Daher kann man auf einem hohen Berg Wasser schon bei deutlich unter 100°C zum Sieden bringen. Bei einem sehr geringen Druck von nur noch 6,1 hPa treffen sich Schmelz- und Dampfdruckkurve im sogenannten Tripelpunkt. Hier kommt Wasser bei einer Temperatur von 0,01 °C in allen drei Aggregatszuständen gleichzeitig vor. Weitere Eigenschaften des Wassers und ihre Bedeutung sind in der folgenden Tabelle beschrieben.
The Open University (1995): Seawater: Its Composition, Properties and Behaviour, p. 6
Gelöste Salze verändern die Eigenschaften von Wasser. Je salziger Ozeanwasser ist, desto höher ist seine Dichte und desto tiefer liegt seine Gefriertemperatur. Der Salzgehalt von Meerwasser spielt also eine wichtige Rolle bei der Meereisbildung.
Die im Ozeanwasser gelösten Salze sind „dissoziiert“, liegen also getrennt in Form von geladenen Teilchen (Ionen) vor. Etwa 99,9 Prozent der im Meerwasser enthaltenen Salze werden durch einige wenige, negativ geladene Moleküle (Anionen) und positiv geladene Teilchen (Kationen) gebildet. Die wichtigsten Anionen sind Chlorid (Cl-), Sulfat (SO4-2), Bicarbonat (HCO3-), Bromid (Br-) und im Wasser dissoziierte Borsäure (H2BO3-). Die wichtigsten Kationen sind Natrium (Na+), Magnesium (Mg2+), Calcium (Ca2+), Kalium (K+) und Strontium (Sr2+).
Gemäß dem Prinzip der konstanten Proportionen, liegen diese Ionen unabhängig vom Gesamtsalzgehalt des Meerwassers immer im gleichen Verhältnis zueinander vor. Dadurch ist es möglich, den Gesamtsalzgehalt von Ozeanen näherungsweise mit nur einer Zahl – der Menge der Chlorid-Ionen – zu beschreiben.
Angegeben wird der Salzgehalt in der Regel als absoluter Salzgehalt in Prozent (%) beziehungsweise in Promille (‰) - Salinität. Das heißt, bei einem Salzgehalt von 1‰ enthält ein Wasserkörper 1 Gramm Salz auf 1 Kilogramm (also 1 Liter) Wasser.
Der Salzgehalt der verschiedenen Ozeane schwankt und wird auch von der Ozeanströmung mit beeinflusst. Der mittlere Salzgehalt in den Ozeanen beträgt 34,7 Promille, dabei ist die Verteilung um den Mittelwert relativ klein. 50 Prozent aller Ozeane weisen einen Salzgehalt zwischen 34,6 und 34,8 Promille auf. Der Salzgehalt in den Ozeanen schwankt zwischen 32 und 38 Promille (Krauß, 2011). Werden die Schelfmeere mitgerechnet, deren Salzgehalte relativ hoch beziehungsweise niedrig sein können, liegen die Werte zwischen 28 und 40 Promille.
Die relativ starken Abweichungen in den küstennahen Randmeeren entstehen dadurch, dass natürliche Prozesse den Salzgehalt verändern können. Dazu gehören unter anderem Verdunstung, Niederschlag und Süßwasserzufluss von den Kontinenten:
- In den Randmeeren der gemäßigten Breiten der nördlichen und südlichen Halbkugel ist der Salzgehalt geringer, weil hier relativ viel Süßwasser durch Flüsse und Niederschlag eingetragen wird.
- In den Randmeeren der subtropischen Breiten überwiegt dagegen die Verdunstung gegenüber Flusszufuhr und Niederschlag, und der Salzgehalt ist teilweise höher als im offenen Ozean.
In der Ostsee schwankt der Salzgehalt stark. Vor der Küste Schleswig-Holsteins liegt er zwischen 15 und 18 Promille. Weit im Osten zwischen Schweden und Finnland transportieren viele Flüsse Süßwasser in die Ostsee. Hier liegt der Salzgehalt bei nur 3 bis 5 Promille. | Im Toten Meer beträgt der Salzgehalt bis zu 330 Promille. Das viele Salz erhöht die Dichte des Wassers so stark, dass Menschen beim Baden viel mehr Auftrieb haben. | Nordpolarmeer: 32 Promille| Persischer Golf: bis zu 40 Promille | Mittelmeer: bis zu 39 Promille | Rotes Meer: bis zu 41 Promille | Atlantik: zwischen 34.5 und 37 Promille
Krauß J, (2011): Grundzüge der Maritime Meteorologie und Ozeanographie, Salzwasserverlag, Paderborn, p. 172
Von großer Bedeutung für die Eisbildung auf dem Meer ist der Zusammenhang zwischen Gefrierpunkt und Dichtemaximum bei jeweils unterschiedlichem Salzgehalt.
Anders als Süßwasser gefriert salziges Wasser erst bei Temperaturen unter null Grad Celsius. Grund dafür sind bestimmte Wechselwirkungen zwischen den Salzen und den Wassermolekülen. Je salziger das Wasser ist, desto tiefer sinkt der Gefrierpunkt. Diese Gefrierpunktserniedrigung verläuft dabei linear (hellblaue Gerade in obiger Abbildung). Ähnlich verändert sich bei steigendem Salzgehalt auch die Temperatur der maximalen Dichte von Wasser (dunkelblaue Gerade).
Doch mit steigendem Salzgehalt sinkt die Temperatur maximaler Dichte viel stärker als die des Gefrierpunkts. Deshalb treffen sich beide Geraden bei einer Temperatur von ca. -1,3 Grad Celsius und einem Salzgehalt von 24,7 ‰. Bei noch höheren Salzgehalten sind der Gefrierpunkt und die Temperatur maximaler Dichte immer identisch. Eine noch größere Dichte unterhalb des Gefrierpunktes kann nicht erreicht werden, da während des Gefrierprozesses von Meerwasser ein Teil der darin enthaltenen Salze ausfällt, was die Dichte des Meereises wieder verringert (Tardent, 2005)
Die Folge ist, dass Meerwasser ab einem Salzgehalt von 24,7 ‰ die Besonderheit der Dichteanomalie verliert. Während sich fast alle Flüssigkeiten beim Gefrieren zusammenziehen und sich dadurch ihre Dichte erhöht, dehnt sich Wasser beim Erstarren aus. Reines Wasser hat seine größte Dichte deshalb nicht bei null, sondern bei 4 Grad Celsius.
Kühlt also beispielsweise ein Süßwassersee im Winter an der Oberfläche aus, sinkt das schwerste 4 Grad Celsius kalte Wasser immer ganz nach unten und bleibt dort. Das noch kältere Wasser nahe null Grad treibt an der Oberfläche. Der See friert deshalb von oben her zu und bleibt in der Tiefe flüssig.
In sehr salzigem Meerwasser läuft der Prozess etwas anders ab. Wegen der fehlenden Dichteanomalie ist hier das kälteste Wasser auch immer das schwerste. Kühlt es an der Oberfläche ab, sinkt es auf den Grund der Deckschicht (etwa 50 bis 100 Meter dick) und verdrängt dort wärmeres Wasser, das nach oben „nachrückt“. Dann wird es wiederum selbst durch noch kälteres Wasser von der Oberfläche verdrängt und nach oben geschoben. Dieser Prozess sorgt für eine konstante Durchmischung der Deckschicht, die sich so lange fortsetzt, bis die gesamte Schicht den Gefrierpunkt erreicht.
Tardent P. (2005): Meeresbiologie, 3. unveränderte Auflage, Thieme-Verlag, pp. 176- 177
Wenn Meerwasser gefriert, wird das Salz nicht in die Eiskristalle eingebaut und verbleibt im restlichen Wasser. Bei hohen Gefrierraten wachsen Eiskristalle an der Oberfläche so schnell, dass das Salz des Meerwassers keine Chance hat, nach unten abzufließen. Hochkonzentrierte Sole wird dann von den Eiskristallen in Soleporen eingeschlossen. Sinkt die Temperatur im Meereis weiter, gefriert ein Teil des Meerwassers in den Soleporen, die dadurch kleiner werden, und der Salzgehalt in der noch flüssigen Sole steigt.
Wie genau sich die Soleporen und damit auch die Struktur des ganzen Meereises bei weiterer Abkühlung verändern, lässt sich gut mit einem Phasendiagramm beschreiben. Darin ist ablesbar, in welchen Zuständen die Salzlösung in den Poren bei einer bestimmten Temperatur und einem bestimmten Salzgehalt vorliegt (flüssige Lösung, flüssige Lösung + Salzkristalle, flüssige Lösung + Eiskristalle, Salz- + Eiskristalle).
Die Abbildung zeigt ein vereinfachtes Phasendiagramm für Wasser (H2O) und darin gelöstes Kochsalz (NaCl).
Besitzt die Lösung eine Salzkonzentration von null Prozent, liegt reines Wasser vor und es gefriert bei 0 Grad Celsius. Mischt man in das reine Wasser bei einer Temperatur von 10 Grad Celsius Kochsalz, so löst es sich so lange, bis ein Salzgehalt von circa 27 Prozent erreicht ist (Punkt 1 der Abbildung). Die Lösung ist dann gesättigt und weiteres Salz bleibt in Kristallform und fällt aus.
Wie verhält sich nun diese 27-prozentige Salzlösung, wenn sie abgekühlt wird? Langsam scheidet sich aus der Lösung festes Salz aus, weil sich bei sinkender Temperatur der Sättigungspunkt verschiebt (im Diagramm rote Linie nach links). Bei -21 Grad Celsius (Punkt 2 der Abbildung) schließlich gefriert die Lösung. Beim Gefrieren trennen sich dann die beiden festen Stoffe, und man findet vermischt sowohl Eis- und Salzkristalle vor.
Was geschieht, wenn eine 10-prozentige Salzlösung (Punkt 3 der Abbildung) von 10 Grad Celsius heruntergekühlt wird? Die Lösung bleibt zunächst flüssig und homogen. Bei einer Temperatur von -7°C (Punkt 4 der Abbildung) bilden sich erste Eiskristalle, das Salz verbleibt in der Lösung und wird aufkonzentriert. Dadurch steigt der Salzgehalt der übrigen Lösung so lange an, bis eine Temperatur von -21 Grad Celsius und eine Salzkonzentration von 23,3 % m/m erreicht ist (Punkt 5 der Abbildung). Dann gefriert das ganze System mit voneinander separierten Eis- und Salzkristallen.
Im mittleren Bereich des Diagramms liegt nur eine Phase vor (flüssige homogene Salzlösung), in den anderen drei Bereichen sind es dagegen je zwei Phasen: rechts eine flüssige Salzlösung mit Salzkristallen, links eine flüssige Salzlösung mit Eiskristallen und unten ein fester Stoff aus Eis- und Salzkristallen.
Wenn also Eis aus Meerwasser zu gefrieren beginnt, wird der Anteil von Wasser in der Lösung immer geringer und der Gefrierpunkt sinkt immer weiter. Dieser Prozess läuft nur solange weiter, bis die Lösung gesättigt ist mit Salz. Die niedrigste Temperatur für eine flüssige Salzlösung ist -21 Grad Celsius. Bei dieser Temperatur beginnt Salz aus der Lösung (als NaCl * 2 H2O) gemeinsam mit dem Eis zu kristallisieren. Die gefrorene Lösung ist dann eine Mischung aus separaten NaCl * 2 H2O Kristallen und Eiskristallen, also keine homogene Mischung aus Salz und Wasser. Diese Form des Phasendiagramms von Salzwasser beschreibt das sogenannte Eutektikum. Das Phasendiagramm zeichnet sich dadurch aus, dass es für den fest-flüssig-Übergang eine flüssige und zwei verschiedene feste Phasen gibt.
Für Meereis, das aus sehr verschiedenen Salzen besteht, sieht ein solches Phasendiagramm natürlich komplizierter aus. Bereits bei einer Temperatur von -2,2 Grad Celsius fällt Kalziumcarbonat aus. Dies setzt sich für abnehmende Temperaturen auch für andere Salze fort. Ausfällungstemperaturen von speziellen Salzen der Lösung sind für Natriumsulfat -8,2 Grad Celsius, für Natriumchlorid -22,9 Grad Celsius, für KCl -36 Grad Celsius und für CaCl -54 Grad Celsius.
Ein Phasendiagramm an sich enthält keine direkten Informationen über die konkrete räumliche Anordnung von einzelnen Phasen innerhalb des Systems „Meereis“ also zum Beispiel über die Mikrostruktur des Meereises. Im Falle von natürlichem Meereis, hängt diese von zwei verschiedenen Faktoren ab: der Umgebung, in der das Eis wächst und den Randbedingungen an der Eis-Wasser-Grenzschicht, sowie der in-situ Temperatur und der chemischen Zusammensetzung der betrachteten Eisschicht. Letztere ist von großer Bedeutung für eine Bandbreite von Meereiseigenschaften, wie z. B. für die physikalischen Unterschiede zwischen Eis, Sole, Salzen und Gaseinschlüssen.
Clarke C. (2012): The science of ice cream, RSC Publishing, 2nd edition, pp..29-30
Wasser nimmt im festen Aggregatzustand – also in Form von gefrorenem Eis – eine Kristallstruktur ein. Diese Gitterstruktur beeinflusst die Eigenschaften von Meereis maßgeblich.
In Abhängigkeit von Druck und Temperatur kann Eis in mehr als einem Dutzend verschiedener Modifikationen – den sogenannten Polymorphen – auftreten. Wasser (H2O) kristallisiert bei Atmosphärendruck und unter natürlich vorkommenden Temperaturen in einer hexagonalen (sechseckigen) Struktur. Andere Erscheinungsformen von Eis treten nur bei sehr hohem Druck und / oder sehr tiefen Temperaturen auf.
In fester (Eis-)form ist jedes Wassermolekül umgeben von vier Nachbarmolekülen. Die Moleküle sind derart angeordnet, dass die Sauerstoffatome der vier Nachbarmoleküle die Ecken eines nahezu idealen Tetraeders bilden. Die Sauerstoffatome wiederum bündeln sich in einer Serie von parallelen Ebenen, die man als Basisebenen bezeichnet. Die Gesamtstruktur erinnert an einen Bienenstock mit Wabenstruktur, der sich aus Schichten mit leicht zerknitterten Sechsecken zusammensetzt.
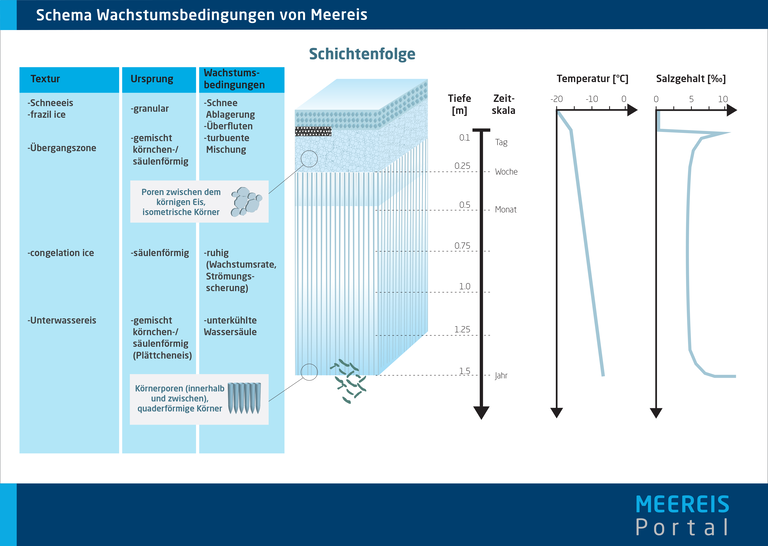
Diese Kristallstruktur bestimmt viele physikalische und mechanische Eigenschaften des Meereises. So hängt das Verhalten von Eis unter anderem von der Richtung der einwirkenden Kraft ab (Anisotropie). Die Kristallstruktur ist außerdem für die Entstehung verschiedener Texturklassen (z. B. säulenförmiges oder körniges Eis) des Meereises verantwortlich.

Bei der Eisbildung entstehen zunächst winzige Ursprungs-Kristalle, durch welche die weitere Wachstumsrichtung des Eises häufig schon vorgegeben wird. Wächst also ein Eiskristall, ist es für ein neues Atom energetisch günstiger, sich an eine bereits existierende Basisebene anzulagern, als eine neue Ebene zu beginnen. Dadurch gibt es im Eis bevorzugte Wachstumsrichtungen, die sich auf vielfältige Weise auch nach außen zeigen – beispielsweise in Form der Arme einer sternförmigen Schneeflocke oder dadurch, dass bei einer bestehenden Meereisdecke neue Kristalle unter dem Eis bevorzugt nach unten wachsen und zentimeterlange Säulen bilden.
Die bevorzugten Wachstumsrichtungen bewirken auch, dass Eis plastisch verformbar ist. Treten Schubkräfte senkrecht zu den Stapelebenen auf, können sich die einzelnen Schichten parallel gegeneinander verschieben oder aneinander vorbeigleiten und das Eis verformt sich. Bei Schub aus allen anderen Richtungen verhält es sich dagegen deutlich „starrer“.
Die Kristallstruktur von Eis lässt sich grundsätzlich mit den sogenannten Bernal-Fowler Regeln beschreiben (Wadhams, 2000).
Bernal-Fowler Regeln
Für gefrorenes Wasser gilt prinzipiell, dass:
- jede Gitterposition von einem Wassermolekül besetzt ist, welches wiederum tetraedrisch von vier Nachbarmolekülen umgeben ist.
- sich zwischen jedem Sauerstoffpaar (O-O) genau ein Wassermolekül (H) befindet, welches die beiden Sauerstoffatome über eine Wasserstoffbrückenbindung verbindet (O-H-O).
- die Wassermoleküle beim Gefrieren intakt bleiben, das heißt jedes Sauerstoffatom bindet zwei Wasserstoffatome in geringer Entfernung (die O-H Entfernung beträgt ungefähr 1 Ångström(Å)) an sich und ist mit zwei weiteren Wasserstoffatomen über eine Wasserstoffbrücke verbunden.
- die Bindungslänge der Wasserstoffbrücken variieren kann, wodurch eine Vielzahl von Konfigurationen möglich ist. Dies ist der Grund für die irreguläre Struktur des Eises.
Wadhams P. (2000): Ice in the ocean, Gordon and Breach Science Publisher, pp. 38-39
Im Winter kühlt die dann sehr kalte Atmosphäre das Oberflächenwasser des Ozeans stark ab. Dadurch steigt seine Dichte und es sinkt in die Tiefe ab, während wärmeres Wasser von unten an die Oberfläche „nachrückt“. Auch dieses Wasser wird durch die Atmosphäre abgekühlt und sinkt in die Tiefe. So entsteht eine konstante vertikale Durchmischung, die so lang andauert, bis die gesamte obere Wasserschicht den Gefrierpunkt erreicht.
Die Deckschicht ist typischerweise zwischen 50 und 100 Meter dick, kann aber durch starke Winde auch mehrere hundert Meter mächtig werden. Darunter liegen im Ozean sogenannte Sprungschichten, an denen sich die Temperatur und der Salzgehalt sprunghaft ändern (Thermokline, Halokline). An diesen Sprungschichten wird die Durchmischung der Oberfläche gestoppt.
Ist die Deckschicht bis zum Gefrierpunkt abgekühlt, formen sich in der Wassersäule kleine Eiskristalle. Weil während des Gefriervorgangs Salz aus den Kristallen ausgeschieden wird, ist ihre Dichte geringer als die des umgebenden Wassers. In der Folge steigen sie langsam an die Oberfläche.
Zunächst formen die Kristalle winzige Plättchen, die nur wenige Millimeter groß sind. Dann wachsen an ihnen kleine Ärmchen, die den Eiskristall wie einen Stern aussehen lassen. An diesem Punkt beschleunigt sich die Kristallneubildung deutlich durch den Prozess der sogenannten „Kristallzüchtung durch Zusammenstoß“ (englisch collision breeding). Die sternförmigen Eispartikel stoßen mit anderen Eispartikeln zusammen und die feinen Ärmchen brechen ab. Diese Bruchstücke bilden wiederum neue Kerne für weitere Kristalle.
So entsteht an der Wasseroberfläche eine Art dünne Suppe aus Eiskristallen, das sogenannte „frazil-ice“, das sich im weiteren Abkühlungs- und Gefrierprozess immer weiter verfestigt (Weeks, 1994).


Wadhams P., (2000): Ice in the ocean, Gordon and Breach Science Publishers, p. 48
Weeks W. F. (1989): Growth conditions and the structure and properties of sea ice, in: Physics of the ice-covered seas, Volume 1, lecture notes from a summer school in Savonlinna, Finland 6-17 June 1994, Helsinki University Press, Helsinki, p. 39
Sobald die Deckschicht des Ozeanwassers den Gefrierpunkt erreicht, bilden sich feine Eiskristalle und Eisplättchen („frazil-ice“). Diese steigen auf und bilden an der Meeresoberfläche eine Art Suppe. Bei ruhigem Seegang und ruhiger Wetterlage entwickelt sich daraus eine geschlossene, glatte Eisfläche, die Nilas genannt wird. Bei unruhigen Bedingungen bilden sich stattdessen aus dem Eisbrei kleinere Schollen, die wegen ihrer Erscheinungsform Pfannkuchen-Eis (englisch „pancake-ice“) genannt werden. Sowohl Nilas als auch Pfannkuchen-Eis können dann zu einer geschlossenen Schicht jungen Eises („young ice“) zusammenwachsen. Daraus kann sich dann je nach Lebensdauer einjähriges Eis mit einer Dicke von 30 bis 150 Zentimetern („first year ice“) und mehrjähriges Eis („multiyear ice“) mit einer Dicke von mehreren Metern entwickeln.


In vielen Regionen der Arktis und Antarktis ist das Meer nicht durchgehend mit Eis bedeckt. So finden sich häufig offene Wasserstellen mitten im Eis, die große Ausdehnungen erreichen können und „Polynjas“ genannt werden. Sie entstehen in der Regel durch Windeinwirkung, Gezeiten oder aufsteigendes warmes Meerwasser, können teilweise über Jahre bestehen bleiben und haben großen Einfluss auf Meeresströmungen, Klima und Meeresorganismen. In Küstennähe entstehen Polynjas vor allem durch ablandigen Wind, der das Eis in Richtung offenes Meer drückt (Küstenpolynjas). Fern der Küsten entstehen Polynjas dagegen vor allem durch auftreibendes, warmes Wasser aus der Tiefe.
Herrschen über längere Zeit sehr kalte atmosphärische Bedingungen, kann Meereis auf eine Mächtigkeit von etwa drei Metern heranwachsen. Eisschollen und durch Gezeiten und Seegang zerbrochenes Eis werden durch Wind und Meeresströmungen beständig bewegt (Meereisdrift). Laufen diese Driftrouten zusammen oder erreichen eine Engstelle (konvergente Drift) werden die Schollen übereinander geschoben (rafting) und aufgetürmt. Dadurch können sogenannte Presseisrücken entstehen, die eine Mächtigkeit von 50 Metern erreichen können.
Lubin D. & Massom R. (2006): Polar Remote Sensing, Volume 1, Atmosphere and Oceans, Springer Verlag, p. 318


















D.N. Thomas D. & G. Dieckmann (2013): Sea ice: An introduction to its physics, chemistry, biology and geology, Blackwell Publishing, p. 23